(图文|信息 编辑|辛西 审核|马彬广)近日,我校农业生物信息湖北省重点实验室、家庭教师av 马彬广教授课题组受邀在国际权威综述期刊《Trends in Biotechnology》(TiB)发表题为《Opto-CRISPR: 基因编辑与调控的新前景》的长篇综述。该文系统梳理了光控CRISPR(Opto-CRISPR)技术的现有机制、应用进展及未来挑战。

文章指出,传统CRISPR/Cas系统因缺乏时空精度而面临脱靶风险、表达泄漏等瓶颈。光遗传学(optogenetics)的引入,为基因编辑装上“精准导航”,使CRISPR获得了“光开关”能力——研究者可用不同波长的光束远程、可逆、无损地启动或关闭基因编辑与转录调控。马彬广团队将现有Opto-CRISPR机制归纳为五大类(图1):包括光学控制Cas9/sgRNA转录、构建光敏Cas9蛋白、光笼化sgRNA、光敏抗CRISPR(Acr)蛋白阻断系统活性、光响应纳米载体递送RNP复合物等。文中用18页篇幅、5幅示意图和1张系统对比表,详尽解析了从蓝光到远红光、从体外细胞到活体小鼠的近40种代表性平台。
在应用层面,文章重点介绍了Opto-CRISPR在三大前沿领域的突破性案例:其一,基础研究,借助亚微米级激光诱导DNA双链断裂,在活细胞中以“秒级”精度解析DNA损伤应答的时序网络;其二,合成生物学,通过红光-可控转录激活系统PhiReX 2.0,使cyc1基因的表达上调6倍,在酿酒酵母中实现代谢流的动态重排;其三,精准医学,利用近红外-上转换纳米颗粒递送CRISPR/Cas9与光敏药物Ce6,在小鼠肿瘤模型中实现基因编辑与光动力治疗的协同杀伤,显著抑制肿瘤生长且副作用极低。
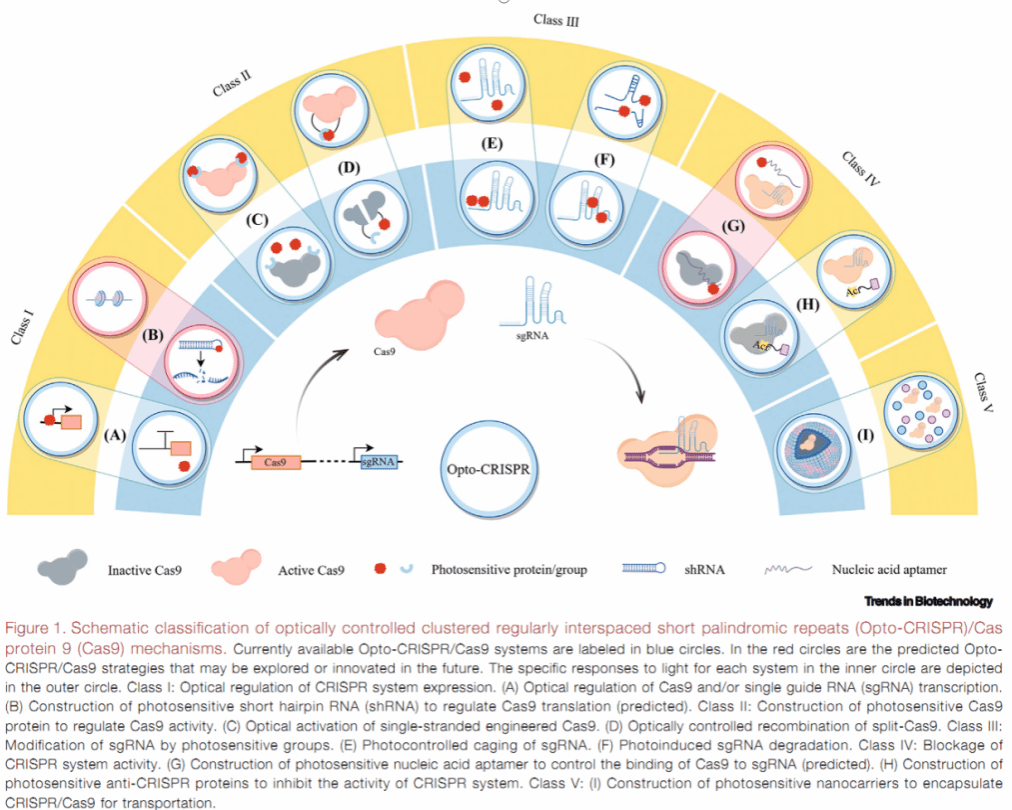
更具开创性的是,综述首次提出2条尚处概念验证阶段的新路线:“光控shRNA”策略——在Cas9 mRNA的5'或3'非翻译区嵌入光敏元件,利用shRNA的光诱导表达或降解,瞬时关闭或重启Cas9蛋白合成,从而以“翻译开关”的形式避免持续表达导致的毒副作用; “光控适配子门”策略——设计可与sgRNA或Cas9结合的光敏DNA/RNA适配子,在黑暗状态下封闭RNP复合物的形成,光照后适配子构象变化解除抑制,实现“零泄漏”启动。
研究者认为,这2条路径一旦成熟,有望突破现有光敏蛋白体积大、光毒性高、组织穿透受限等瓶颈,为临床级精准基因疗法提供新范式。
更引人注目的是,团队首次提出“AI-Opto-CRISPR”闭环控制范式:即通过强化学习算法动态优化光脉冲参数(波长/强度/时长),实时反馈调控基因编辑效率。这一概念将推动基因编辑迈向智能化、自适应时代。
针对植物体系滞后于动物和微生物的现状,综述提出“节律同步”设计思想——结合植物内源光周期通路,开发对远红光/蓝光敏感但避开叶绿素强吸收波段的光控元件,从而与作物光合作用节律同步,实现田间无损基因调控。
文末,作者列出6项亟待攻关的“Outstanding questions”,包括多波长光学参数优化、AI闭环控制算法、植物特异递送、跨学科技术融合与生物安全评估等,为后续研究指明方向。该综述不仅为全球Opto-CRISPR研究提供了全景式蓝图,也彰显了我校在农业生物信息学及基因编辑前沿领域的国际影响力和持续创新力。该成果的发表得益于课题组在光遗传学与合成生物学交叉领域的长期积累,相关技术有望在遗传病治疗、生物制造及智能育种中率先落地应用。
论文第一作者为我校在读研究生黄慧聪同学,通讯作者为生物信息系马彬广教授。研究得到国家自然科学基金(31971184)及中央高校基本科研业务费(2662024SZ001、2662024JC001)资助。
论文链接://www.cell.com/trends/biotechnology/fulltext/S0167-7799(25)00257-4
